- マウス遺伝学の歴史
はじめはペットから・・・
マウス(日本名:ハツカネズミ、もしくはイエネズミ、学名:Mus musculus)は、古くからヒトとの結びつきが深く、哺乳動物の中では最も遺伝学の研究が進んでいる動物です。古来より日本、ヨーロッパなどでは、マウスを愛玩動物(ペット)として飼う習慣がありました。紀元前6世紀頃の中央アジアの遺跡では、マウスのブロンズ像が出土していますし、日本においても江戸時代に北斎や河鍋暁斎などにより浮世絵に描かれています。また江戸時代中期には、マウスの飼い方の手引書(珍翫鼠育草:ちんがんそだてぐさ)も大阪で出版されています。この珍翫鼠育草には、単に飼い方のみではなく、毛変わり(毛色の突然変異体)などの記載もされており、またその変異体を如何に後世に残すかの秘伝が書かれています。メンデルの法則が発表されたのは、珍翫鼠育草の100年あまり後なので、古くから日本人は感覚的に遺伝学の原理の一部を理解していた事が伺えます。
近郊系統の樹立が発展の鍵
マウスを用いた遺伝学が進んだ理由の一つとして、多くの近交系統(遺伝的に均一な系統、即ちDNA配列が同一)の樹立が行なわれた事が挙げられます。現在、一般的に用いられている実験用マウス系統は、多くがアメリカ東海岸で樹立されました。これも出発点は、ペットのマウスたちです。Massachusetts州GlanbyのAbbie Lothrop女史は、教員引退後に彼女の趣味であったマウスの交配を本格化し、ブリーダー業を始めました。このマウスたちを、同じくMassachusetts州にあるHarvard大学出身の生物学者、C. C. Little博士がLothrop女史より入手し、1900年代初頭に系統化したものがC57BL/6系統やDBA系統などです。その後、数多くのマウス系統が主に癌研究のために樹立されました。
国立遺伝学研究所の野生由来マウス系統
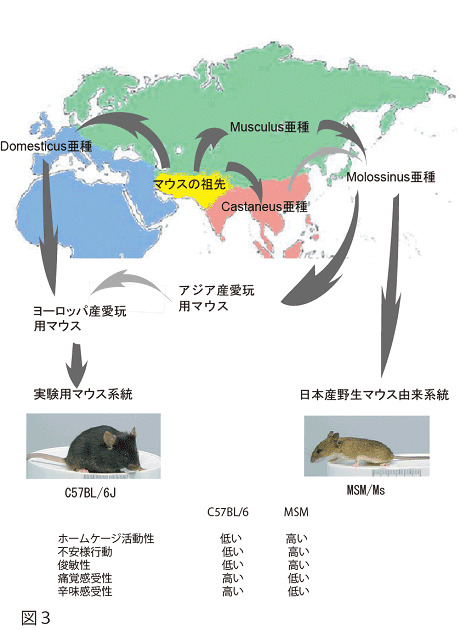
一方、日本においては1970年代から国立遺伝学研究所・森脇和朗博士らにより、ペット由来ではなく、アメリカ大陸、西ヨーロッパ、東ヨーロッパ、中国、東南アジア、中央アジア、そして日本に生息していた野生ネズミから多くのマウス系統が樹立されました。これらの野生由来マウスを詳しく解析した結果、それらは相互に遺伝的に大きく離れていることがわかりました。現在、世界には大きく分けて3種類のグループ(西ヨーロッパのdomesticus亜種、ユーラシア大陸の北部を東ヨーロッパから極東の広い地域に分布するmusculus亜種、それに東南アジアに生息するcastaneus亜種)が知られています。日本産野生マウスは、musculus亜種とcastaneus亜種の雑種であることもわかってきました。森脇博士らが樹立したMSM/Ms(Mishima:ミシマ)系統は、国立遺伝学研究所のある静岡県三島市で捕獲された野生マウスから樹立されたマウス系統で、実験用マウス系統とは異なる形質(例えば癌にならない、皮下脂肪が厚い、活発に行動するなど)を示し、遺伝学的に重要な系統です。

図[MSM/Ms系統]パンダみたいなマウスを発見!
また、森脇博士は日本産ペットマウス由来JF-1/Ms系統の樹立も行ないました。JF-1/MsはデンマークのNielsen博士が飼っていたマウスを系統化した物ですが、非常に興味深い事に「珍翫鼠育草」に出てくる“豆ぶち”とそっくりだったのです(日本国内の豆ぶち系統は戦前に絶滅)。その後、JF-1/Msの遺伝的解析が行なわれ、この系統が間違いなく日本マウス由来である事が確かめられました。JF-1/Ms系統は、おとなしく、非常に飼いやすいと共に遺伝的に実験用マウス系統と異なるので、特にエピジェネティクス研究(別項参照)に多く使われています。

図[JF-1/Ms系統]順遺伝学と逆遺伝学
マウス遺伝学の特徴として、順遺伝学(フォワードジェネティクス、特定の形質に立脚してその違いを決める遺伝子を交配実験により明らかにする)と逆遺伝学(リバースジェネティクス、特定の既知遺伝子に立脚してその遺伝子に人為的改変を加えた結果の形質の変化を解析する)の二つの方法論が駆使できる点を挙げる事が出来ます(別項参照)。マウスは近交系統のみならず突然変異系統、コンジェニック系統、コンソミック系統など多くの系統群が存在し順遺伝学に使用されています。また、万能細胞と呼ばれる胚性幹細胞(ES細胞)が樹立され、遺伝子ノックアウトの手法を使って逆遺伝学を行うことが可能です。
ますます高まる重要性
2002年にはマウスゲノムDNAの配列情報がほぼ全て解読されました。それらの情報から、マウスのタンパク質をコードする遺伝子数やヒト遺伝情報との対応関係も明らかになっています(別項参照)。国立遺伝学研究所ではMSM/Ms系統のゲノム解読を進めており、多の系統と比較してDNA配列上に大きな違いがあることも分かってきました。これらのゲノム情報と様々なマウス系統を用いて、形態形成、疾患、行動など高次機能に関わる遺伝子を最新の手法により見出し、それらの働きを分子レベルで解析して、身体づくりの仕組みや病気が生じる原因を明らかにする研究が進んでいます。
文責:田村勝、城石俊彦
- マウスゲノムの概要
ヒトとマウスのゲノムを比べてみると・・・
マウス(Mus musculus)のゲノムは2002年に解読され、その概要が発表されました。マウスゲノムのサイズは約25億の塩基対からなり、ヒトゲノムのサイズ約29億塩基対に比較して約14%程小さくなっています。マウス、ヒトともに遺伝子の総数は高々3万ほど(最近の見積もりではさらに少なくヒトで2万2千個程度)と見積もられていて、ほとんど同じです。マウスだけにあってヒトには存在しない遺伝子(あるいはその逆)の割合は1%以下です。9割ほどの遺伝子の染色体上での並び順はマウスとヒトとの間で対応をつけることができます。特に機能を持たない中立進化している塩基を見ると、ヒトとマウスでは約50%の塩基が違っています。逆に、機能を持つために純化淘汰を受けて進化上保存しているゲノム領域の割合は約5%に達しています。タンパク質をコードする遺伝子の領域は約2%程度ですので、残りは遺伝子の転写調節機能を司る領域やタンパク質をコードしないRNA遺伝子(ncRNA)などではないかと考えられています。
RNAの新大陸を発見!
最近になって、マウスゲノムの約70%もの領域がRNAとして転写されていることが解りました。タンパク質をコードする遺伝子の研究に加え、今後こうしたタンパク質をコードしないゲノム領域の機能解析が進むと、マウスゲノムが「マウスらしさ」を作り出す理由がわかるかも知れません。
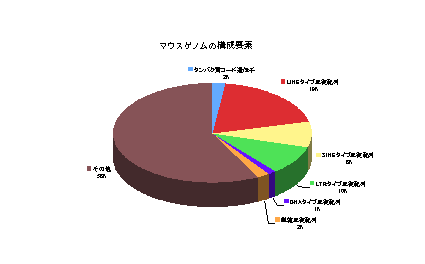
図:マウスゲノムの構成要素(数字はNature.2002 420:520-562より)文責:隅山健太
- フォワードジェネティクス(順遺伝学)
表現型からすべてがはじまる
フォワードジェネティクス(順遺伝学)は、遺伝性がみられる形質(表現型)からその原因となる遺伝子を探り当てる研究を指します。これは本来の遺伝学の手法でもあります。“phenotype-driven”アプローチと呼ばれることもあり、野生型とは異なる表現型を示すマウスを見出すことが出発点となります。新たな表現型を見出す過程をスクリーニングといい、興味のある表現型を効率よく検出する方法を各自工夫します。マウスでは自然発生突然変異マウス、X線誘導突然変異マウスなどのコレクションが公開されており(Genetic Variants and Strains of the Laboratory Mouse, Mary F. Lyon et al., 1996, Oxford University Press他)、それらが表現型を見つける母集団となります。また、最近では日本を始めアメリカ、ヨーロッパ各国において化学変異誘導剤であるエチルニトロソウレア(ENU)を用いた大規模突然変異マウス作出プロジェクトが行なわれ、ほぼ変異体マウスが出尽くした感があります。こちらも各プロジェクトのホームページなどを通して公開され、入手が可能です。
主な情報源、入手先
国内:
国外:
遺伝子マッピングとポジショナルクローニング
目的とする表現型を支配する原因遺伝子が、染色体上のどの位置に存在するかを調べる遺伝学的手法です。表現型を示す系統と示さない系統の間で交配して得られた次世代の多数の個体について、表現型とDNAマーカー(塩基配列の違い)の相関を調べる(連鎖解析と呼びます)ことで表現型を支配する遺伝子に物理的に近いDNAマーカーを決定します。
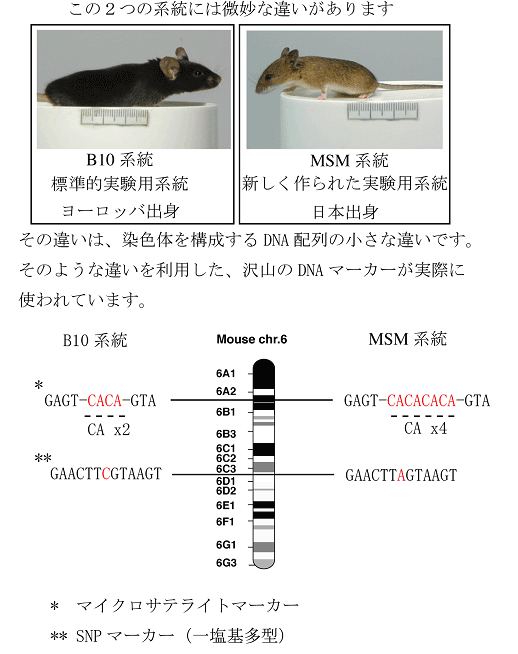
図1:DNAマーカー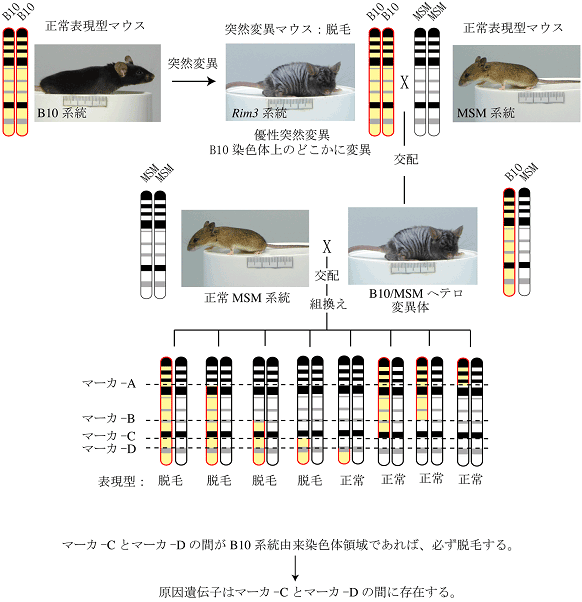
図2:遺伝子マッピング詳細な染色体上の位置が解れば、公開されているゲノム情報を利用して、塩基配列情報を得る事が出来ます。また、マッピングした領域に存在する遺伝子も即座に判明します。このようにマッピングを経由して原因遺伝子を突き止める手法をポジショナルクローニングと言います。
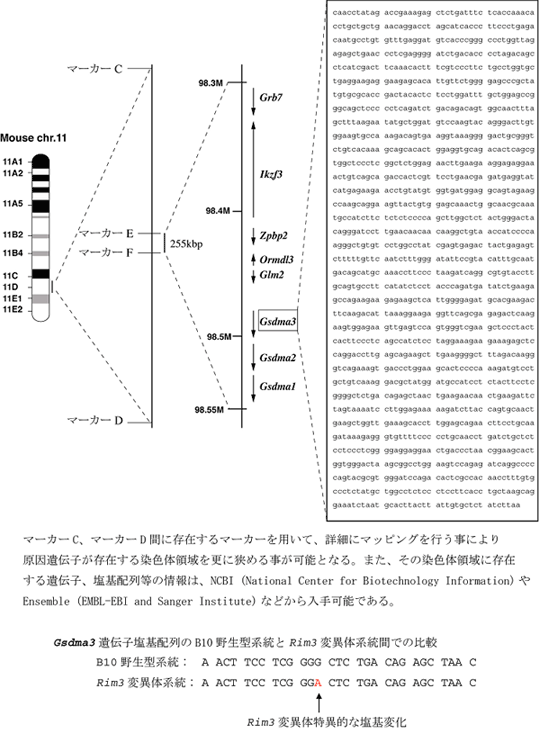
図3:原因遺伝子を突き止める因果関係を証明するには・・・
マッピングした領域に存在する遺伝子の中に、変異体に特異的な塩基配列の変化が検出されました。さてこの遺伝子は表現型の原因遺伝子でしょうか?いいえ、まだこの段階では、候補遺伝子であって原因遺伝子とまでは言えません。
一般に、表現型が劣性遺伝(ホモ接合体だけで表現型が現れる)の場合は、野生型の候補遺伝子を変異体に導入し、レスキュー実験を行ないます。遺伝子導入マウスに異常表現型の回復が見られれば、この段階で候補遺伝子は原因遺伝子であったと言えます。また、表現型が優性遺伝(ヘテロ接合体にも表現型が現れる)の場合、変異体と同じ塩基配列変化を導入した候補遺伝子を用いてマウスを作製し、これが変異体と同じ表現型を示した時点で原因遺伝子であると言うことが出来ます。この他にも候補遺伝子に既知の変異体がいくつか存在する場合には、それら既知変異体を用いて相補性検定を行なう事により原因遺伝子の確定を行なう事ができます。ふたつのジェネティクスの違いは?
遺伝子を操作してその表現型を調べるリバースジェネティクス(別項参照)では、作製した変異体マウスの表現型を見て驚きますが、フォワードジェネティクスでは同定した原因遺伝子を見て驚きます。更にフォワードジェネティクスで見つかる変異のタイプは点突然変異、挿入変異、欠損変異、転座変異と様々なので、新たな遺伝子機能に迫れる可能性を秘めています。現在、変異体マウスは遺伝子の機能を研究する上で必須の道具となり、ヒト疾患の新規治療薬や診断法を開発するためにも有用です。その一翼を担っているのがフォワードジェネティクスなのです。
文責:田村勝、城石俊彦
- リバースジェネティクス(逆遺伝学)
リバースジェネティクスにノーベル賞
リバースジェネティクス(逆遺伝学)とは、特定の遺伝子を選択的に欠失・破壊することによって、その遺伝子の機能を解析すること。従来の遺伝学(フォワードジェネティクスとも言う、別項参照)と全く逆の手順を踏んでいることからそう呼ばれます。マウスにおけるリバースジェネティクスは、遺伝的な操作を施した胚性幹細胞(ES細胞)からマウス個体を作成する画期的な技術の確立によって現実のものとなりました。一連の技術開発に携わった3人の科学者はその功績が認められ、2007年にノーベル生理学医学賞を受賞しました。まずMartin J. Evans(英国)が哺乳類で初めてとなるマウスのES細胞を作り出し、さらにMario R. Capecchi(米国)とOliver Smithies(英国)が相同組み換えを利用して染色体上の特定遺伝子を別の遺伝子で置き換える手法を開発し、遺伝子改変マウスを作成したのです。この手法は、現在の生命科学にとって欠かせないものとなっています。
ノックアウト(標的遺伝子破壊)マウスとは?
上記の方法で人為的に標的とする遺伝子を破壊した変異マウスのことをこうよびます。特定の遺伝子の破壊によって個体に生じる様々な現象を介して、その遺伝子の機能を明らかにすることができるのです。また作成されたノックアウトマウスは、ヒト疾患モデル動物としても各方面から注目を集めています。ここでは、一般的なノックアウトマウス作成技術の概要を述べます。
ノックアウトマウスの作成法
- ターゲティング(標的遺伝子破壊)ベクターを構築する
標的となる遺伝子座で組み換えを起こすための相同領域を、組み換えが起きた細胞を選別するための選択マーカー遺伝子(G418耐性遺伝子やハイグロマイシン耐性遺伝子など)の両端に組み込んだターゲティングベクターを作成します。 - 相同組み換えES細胞を得る
構築したターゲティングベクターをエレクトロポレーション法等によってES細胞へ導入します。ある確率で相同組み換えが起こり、標的とする遺伝子が選択マーカー遺伝子に置き換わります。このマーカー遺伝子の薬剤耐性を指標に、組み換えを起こしたコロニーを選別します。実際に組み換えが起こったことをサザンブロット法などで確認します。 - ES細胞からキメラ個体を作る
相同組み換えES細胞を、ホスト(宿主)となるマウスの胚盤胞(発生初期の胚)の腔内に顕微操作で注入、または8細砲期胚と共培養して集合させ、ホスト胚の細胞とES細胞の2つの胚から由来する細胞で成り立つ(キメラと呼びます)胚盤胞を得ます。これを仮親となる雌マウスの子宮に移植し、産仔においてキメラ個体が得られます。ES細胞確立の際の胚とホスト胚とで異なる体毛色の系統を使用すると、キメラ個体か否かを得られた個体の体毛色で判別できるのです。 - ノックアウト個体を産生する
得られたキメラマウスを正常マウスと交配して、ヘテロ接合体の個体を産生します(ジャームライントランスミッションと呼びます)。相同組み換えES細胞由来の遺伝形質を持つ個体であるかどうかを確認します。ヘテロ接合体同士を掛け合わせて、ホモ接合体の遺伝子ノックアウトマウスが得られます。
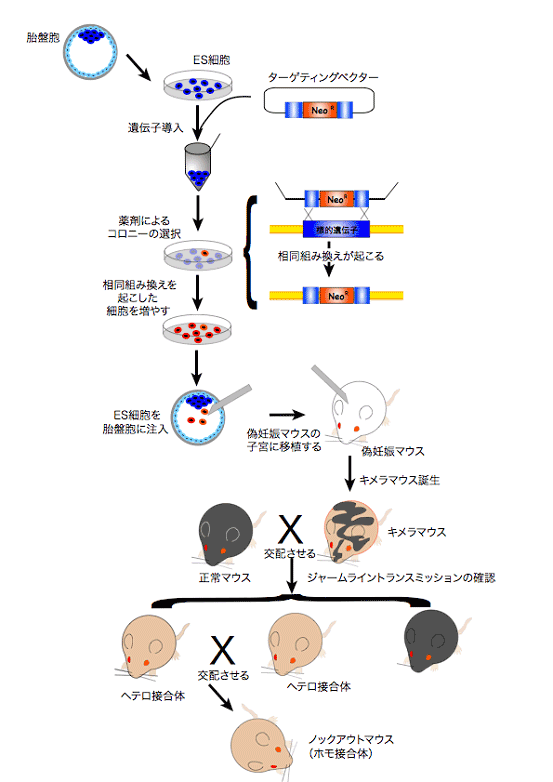
図1:ノックアウトマウス作成の流れノックアウトマウスの実例
遺伝研発生工学研究室では、上述した手法で多くのノックアウトマウスを作出し、発生遺伝学的解析を行っています。以下にその例を挙げます。
図2:Mesp2遺伝子ノックアウトマウス
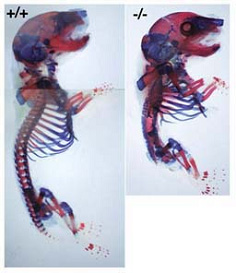
このマウス(右)の骨格標本を見ると、脊柱骨の形成に異常が認められます(左は野生型マウス)。脊椎動物の脊椎骨、筋肉、血管、神経は整然とした繰り返し構造を持っていますが、こうした構造は発生の過程で一過的に一定の間隔で形成される体節とよばれる構造が基盤になっています。このマウスの解析でMesp2遺伝子が体節形成に重要な役割を果たすことが明らかになりました。体節形成の異常はヒトの脊椎骨形成不全、脊椎骨、肋骨の癒合など遺伝病の原因となっており、今後このような病気に対する治療法の確立などに役立つことが期待されます。
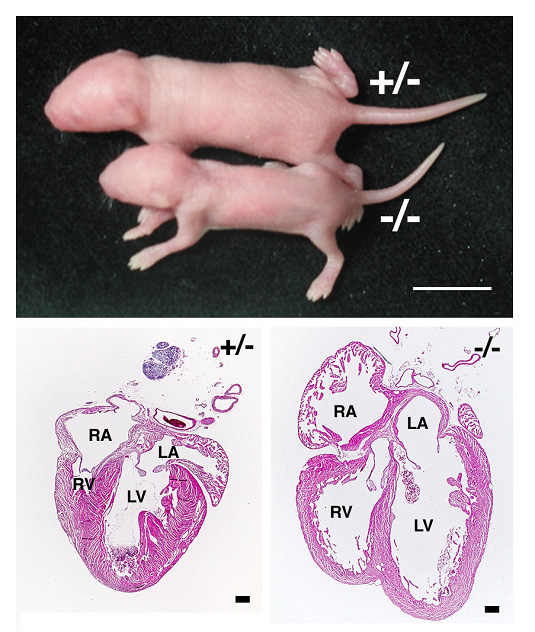
図3:Hesr2遺伝子のノックアウトマウス
このノックアウトマウスには生育遅延が見られ(小さい方の新生仔)、心臓が拡大します(下右)。心臓弁の形成異常によって血行動態の異常が引き起こされるのです。ヒトの生後1年の間の死因のトップは先天性心疾患であり、成人においても心臓疾患はガンに次ぐ死亡原因です。今後このような心疾患に対する治療法の確立などに役立つことが期待されます。
文責:小久保博樹、相賀裕美子
- ターゲティング(標的遺伝子破壊)ベクターを構築する
- マウスのエピジェネティクス
エピジェネティクスってなに?
遺伝子の機能がDNA配列の置換や欠失などの突然変異によって損なわれると、その影響は細胞分裂を通して、あるいは世代を越えて受け継がれます。このような遺伝的変化に対し、DNAの変化を伴わずに遺伝子の機能を変化させ、かつ伝達する仕組みを、エピジェネティクスといいます。DNAのメチル化やヒストン蛋白質のさまざまな化学修飾がその仕組みの基盤となっています。これらエピジェネティックな修飾が協調的に作用することによって、遺伝子の発現が制御されるのです。エピジェネティックな制御はゲノムの遺伝情報を場面に応じて適切に引き出すために重要な役割を果たし、それによって組織の多様性や表現型の多様性が生まれるとも言えます。また、次に述べるようなエピジェネティックな現象が、マウスを使って研究されています。
X染色体不の活性化・・・三毛猫の模様
哺乳類のオスはXY、メスはXXの性染色体構成をもつので、メスではX染色体の遺伝子がオスの2倍あります。Y染色体は性決定(オス化)や精子形成にかかわる遺伝子が50個程度あるだけの小さな染色体で、その有無が動物の生存に影響することはありません。しかし、X染色体には生存に必須なものを含め1,500個もの遺伝子があるので、雌雄間で遺伝子量の差を是正する必要があります。そのための機構がX染色体不活性化です。つまり、哺乳類のメスは2本あるX染色体の1本を不活性化し、働きのあるX染色体の数がオスと同じ1本になるようにするのです(図1)。その際、不活性化されるX染色体は2本のX染色体からランダムに選ばれることが分かっています(例外もあります)。
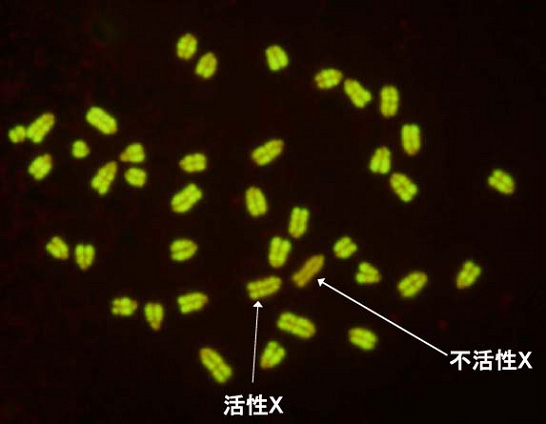
図1:不活性X染色体
メスのマウスの細胞の染色体を不活性な部分が暗く見える方法で染色してあります。2本のX染色体のうち暗い方が不活性なX染色体です。
身近な例では、三毛猫(すべてメス)の茶と黒を決める遺伝子がX染色体にあり、不活性化の起こり方で模様が決まることが知られています。
X染色体不活性化は発生の初期に起こり、メスのほとんど全ての細胞で観察されます。しかし、卵子形成過程では不活性化なX染色体が活性を取り戻し、その後の減数分裂を経て次世代へ伝えられます(図2)。X染色体は、DNA配列の変化をともなわないエピジェネティックな仕組みで制御されているため、不活性化と再活性化のサイクルを繰り返すことができるのです。
図2:哺乳類のX染色体の不活性化と再活性化
赤・青のXはそれぞれ母由来・父由来のX染色体を示し、大文字・小文字のXはそれぞれ活性・不活性のX染色体を示しています。
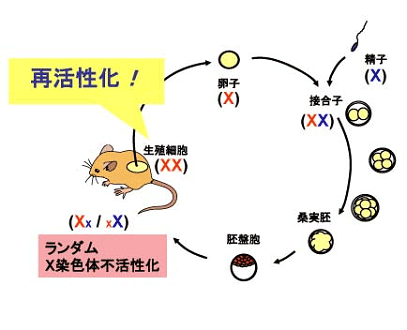
ゲノムインプリンティングと単為発生マウス「かぐや」
二倍体の生物ではふつう一対(父由来・母由来)の遺伝子の機能は等価です。しかし、哺乳類の特定の遺伝子座では、その遺伝子が働くか働かないかはどちらの親に由来するかで異なり、例えば母由来の遺伝子は発現するが父由来の遺伝子は発現しない、というようなことが見られます。このように、父由来・母由来の遺伝子の間に質的な違いを形成する機構がゲノムインプリンティング(ゲノム刷り込み)です。
ゲノムインプリンティングによって制御される遺伝子には、卵子と精子が作られるときに特有なエピジェネティックな印がつけられます(図3)。この印の役割を果たすのがDNAメチル化です。印は世代毎に母由来タイプもしくは父由来タイプに書き換えられるので、インプリンティングは哺乳類におけるエピジェネティック制御の代表例といえます。
図3:ゲノムインプリンティングのサイクル
赤・青の棒はそれぞれ母由来・父由来の印のついたゲノムを表わします。インプリンティングは世代毎に書き換えられます。
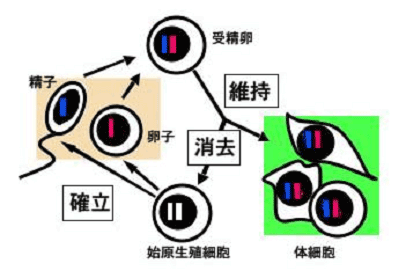
哺乳類で単為発生(未受精卵から個体ができること)が観察されないのは、インプリンティングのため母由来ゲノムが父由来ゲノムの代わりをできないからです。2004年に東京農業大学の河野友宏らにより単為発生マウス「かぐや」が発表されましたが、これはインプリンティングを人工的に改変することにより初めて可能になったのです。文責:佐渡敬、佐々木裕之
- マウスの行動遺伝学
行動は遺伝するのでしょうか?
私たちは顔かたち同様性格や行動が遺伝することをなんとなく認めてしまっています。しかし、本当に親の性格は子供に遺伝するのでしょうか?遺伝する場合にはどのような遺伝的しくみがかかわっているのでしょうか? このような疑問に答えるため、マウスを用いて盛んな取り組みが進められています。
マウスの行動からヒトの心が理解できる?
言葉を話さないマウスが示す行動から、それが何を意味しているのか、何を感じているか理解するのは大変難しい問題です。そのため、マウスの心理を理解することを目的とした様々な行動テストが考案されてきました。ざっと挙げただけでもオープンフィールドテスト、ホームケージ活動量テスト、新規ケージ活動量テスト、明暗箱テスト、高架式十字迷路テスト、社会行動テストなど多数あります(図1)。

これらのテストは、マウスが新しい場所や高所を不安に感じたり怖がったりしている様子を定量化して比較しようとするものです。更に学習能力を測定するテストなども考案されています。これらのテストから分かるものは、ヒトの心理にも通じるものです。
行動に関与する遺伝的要因をしらべる
遺伝学では、ひとつの遺伝子に変異が生じて表現型が変化するものについては随分研究が進み、遺伝子と形質の関係がつぎつぎと明らかになってきました。例えば、睡眠覚醒の概日リズム(サーカディアンリズム)に関する変異体であるclockの原因遺伝子が発見され、体内時計の制御に関わる分子機構の解明に貢献しました。また、逆にリバースジェネティクス(別項参照)の方法を用いて脳や神経で働くと予想される遺伝子を破壊し、どの遺伝子がどのような行動と関連があるか調べる研究も盛んに行われています。
しかし集団の中の多様性、つまり個人差が生じる原因は単一遺伝子では説明がつかないのです。つまり、集団内における個人差に関わるほとんどの表現型(身長・体重・血圧・疾患のリスクに始まり、行動においても性格・気質・知能といった形質)は、明確に段階分けすることができず連続的に分布していることから量的形(Quantitative trait)と呼ばれています。量的形質には複数の遺伝子が関与していて、その遺伝的機構の解明は大変難しいと考えられています(図2)。こうした形質に関わる遺伝子を解析する試みは量的形質遺伝子座解析(QTL解析)と呼ばれていて、近年盛んに研究されているのです。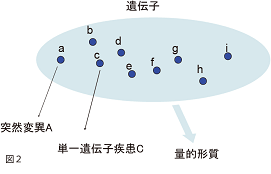
例えば、遺伝的に異なったマウス系統間で行動の違いを見出し、そのような違いに関与する遺伝子座を探索するような試みが進められています(図3)。こうした研究からより身近な行動形質がどのようにして遺伝子による影響を受けているのか明らかになってゆくと期待されています。
文責:小出剛

